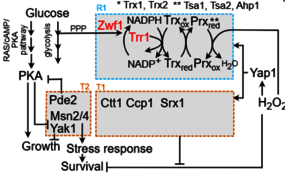
Grâce à la délétion ciblée de ZWF1, le gène codant pour la glucose-6-phosphate déshydrogénase de la voie des pentoses phosphates responsable de la production de NADPH, nous avons observé une diminution prononcée de la résistance au H₂O₂ concomitante à une augmentation paradoxale de la tolérance. En combinant des perturbations génétiques supplémentaires et en variant les conditions nutritionnelles extracellulaires, nous avons démontré que, lors du dépassement de la machinerie homéostatique redox canonique, l'inhibition dépendante du redox de la protéine kinase A (PKA) fonctionne comme un interrupteur moléculaire. Cette inhibition redirige les cellules vers un état tolérant dépendant des nutriments, dans lequel la prolifération est temporairement suspendue, atténuant ainsi les dommages oxydatifs létaux.
En étendant notre analyse à Escherichia coli, notre travail a révélé que le compromis résistance-tolérance est conservé à travers la phylogénie. Ces résultats ont établi un cadre unifié dans lequel la signalisation redox alloue dynamiquement les ressources cellulaires entre les modes de détoxification et de survie. En élucidant la logique réglementaire gouvernant cet équilibre, notre étude fournit une base conceptuelle pour le développement de thérapies combinées qui ciblent simultanément les mécanismes de résistance des pathogènes ou des tumeurs et les défenses de tolérance, avec pour objectif de prévenir l'échappement au traitement et la rechute de la maladie.